

























今日(12月20日),国家卫健委办公厅发布了《新型抗肿瘤药物临床应用指导原则(2019年版)》(下称《原则》),该《原则》由“新型抗肿瘤药物临床应用指导原则”和“各系统肿瘤的药物临床应用指导原则”两部分组成,其中“各系统肿瘤的药物临床应用指导原则”共涉及8类临床药物。

新型抗肿瘤药物临床应用指导原则
(2019年版)



现代抗肿瘤药物的一个显著特征,是出现一批针对分子异常特征的药物——即靶向药物。最具代表性的药物是针对表皮生长因子信号通路异常的酪氨酸激酶抑制剂。目前,根据是否需要做靶点检测,可以将常用的小分子靶向药物和大分子单克隆抗体类药物分为两大类(表1)。具体的检测靶点详见各章节。
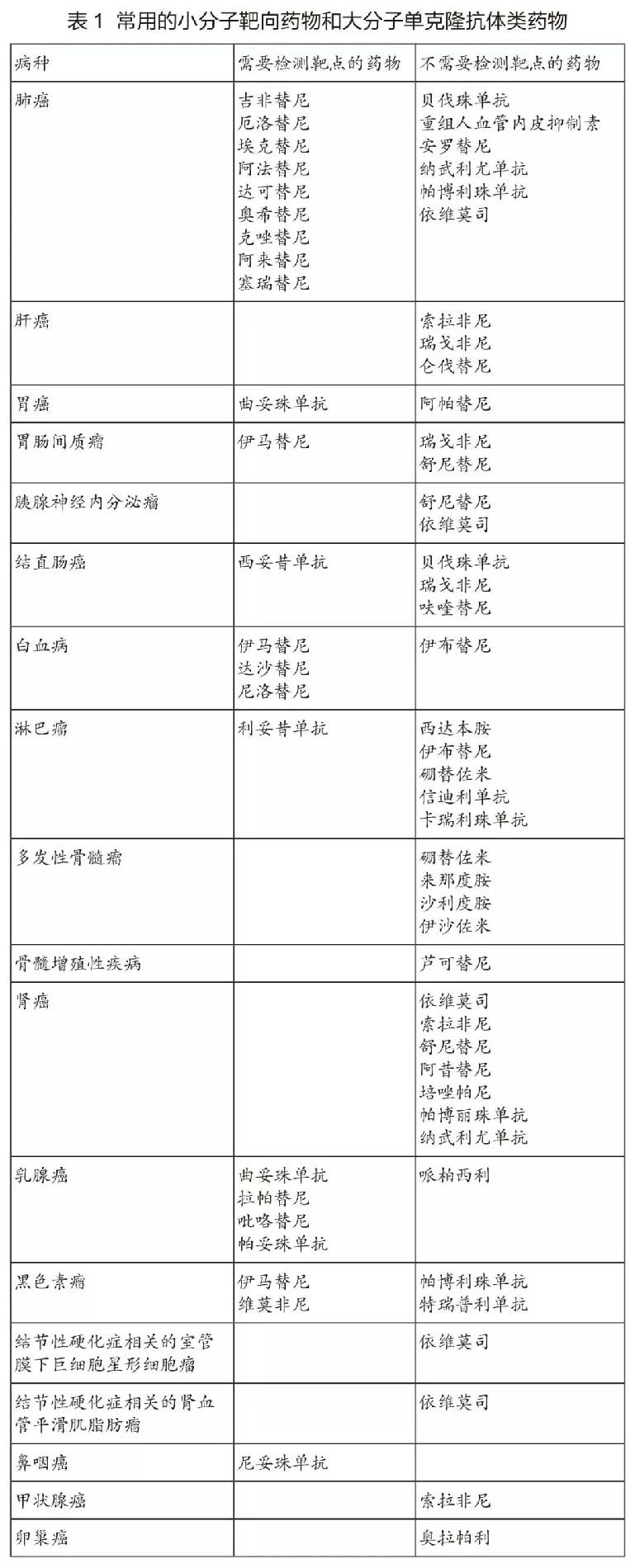
对于有明确靶点的药物,须遵循靶点检测后方可使用的原则。检测所用的仪器设备、诊断试剂和检测方法应当经过国家药品监督管理部门批准,特别是经过伴随诊断验证的方法。不得在未做相关检查的情况下盲目用药。

