临床研究服务
临床前研究服务
取得临床批件
取得生产批件或中药保护
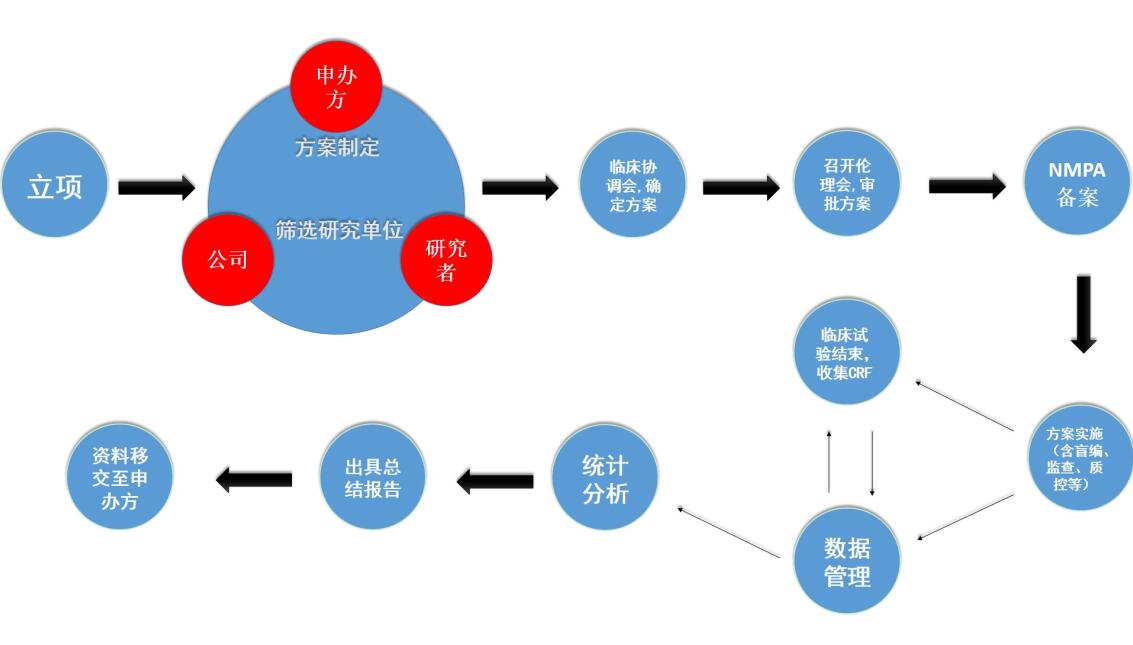
临床研究服务的主要流程如下:
(1)立项
项目成功与申办方签订合作协议后,由商务人员对公司临床部、医学部、数据管理统计分析同时进行立项,并组织召开会议,明确项目范围和申办方的需求。
(2)制定方案初稿及筛选研究单位
公司临床部负责选择临床研究单位(对每个研究单位进行详细的调研和评估),其中一家研究单位作为组长单位(个别申办方会建议某家研究单位作为组长单位),同时联系确定参加单位。医学部负责研究方案初稿的拟定,统计人员进行方案中有关统计学内容的撰写。
(3)召开临床研究协调会
公司、申办者与所有研究单位一起召开临床研究协调会,讨论并确定临床研究方案。
(4)伦理委员会审批,备案
确定临床研究方案后,报组长单位伦理委员会审批。组长单位召开伦理委员会审批临床研究方案等资料,取得组长单位的伦理委员会批件后,将研究方案等资料提交申办者向国家药监局及相关省药监局进行备案登记。如果组长单位伦理委员会审核时对方案等资料提出修改意见的,则需在方案等资料修改后再次召开伦理委员会审批同意才能实施。除组长单位外,其他参加单位会视情况召开分中心伦理审查会议对研究方案等资料进行审批。如果参加单位对临床试验方案等资料提出异议,则需反馈至组长单位及申办方再次对方案进行讨论和修改。如果参加单位对最终确定的临床研究方案等资料还有异议,则可以选择退出该项目的临床研究。临床方案确定后,还需要将组长单位的伦理委员会批件、临床研究方案、药检报告等研究资料在所有参加单位备案。
在获得伦理委员会批件后,由非参与统计分析的统计专业工作人员对申办方提供的临床试验用药物进行随机编盲工作。
涉及外资背景的申办方,需要在伦理获得批准后,申请遗传办备案,获批准后才能开展试验。
(5)临床试验开始、进行、结束
临床研究开始前,临床部与所有临床研究单位签订临床研究协议。临床研究协议签署后,通知申办方将临床试验用药物送达相应研究单位。负责该项目的项目经理和监查员对相关研究者进行临床研究方案的培训,试验正式开始。在临床研究期间,监查员严格按照相关规定,检查入组病例是否符合方案规定的入选要求、排除标准,研究资料是否准确、及时、真实的填写,检查核对实验室数据并出具监查报告。病人出组后,监查员检查核对所有研究中心的病例资料,并回收研究资料和剩余临床试验用药物,清点剩余临床试验用药物返还申办方。
(6)数据管理和统计分析
回收临床研究资料后,数据管理员制定数据管理计划,根据临床试验方案编写数据核查计划,对数据进行检查,出具疑问表提交至研究者进行答疑,根据研究者答疑表对数据库进行修正。答疑结束后,召开数据审核会,会后锁定数据库(盲法试验时需进行揭盲)。统计人员根据锁定的数据库,按照统计分析计划进行统计分析,出具统计分析报告。
(7)总结会、总结报告
统计分析报告完成后,公司各业务部门(包括医学部、临床部、统计分析人员等)与研究单位召开临床研究总结会,对统计分析报告进行讨论和定稿,并对临床研究进行总结。由医学部根据统计分析报告拟定总结报告及各分中心的小结报告初稿,并再次送交各研究单位进行审核定稿、签字确认,将研究者签字确认的总结报告提交各药物临床试验机构签章。临床研究总结报告、小结报告等研究资料是申办者申请新药证书和药品注册批件的重要资料。
(8)质控,资料移交
项目全过程均受质量管理与控制,项目开展前期在质量控制部支持下明确项目的质量管理要求,过程中安排定期对试验文件进行系统检查;申报资料在提交有关部门前,将经过质量控制部安排全面核定以保证其质量。试验完成后,最终通过质控的资料将被统一移交至申办者并签署交接清单。