

























防控降级、复工复产、景区开放、学生复课......经历了近4个月的新冠疫情防控阻击战,中国的疫情防控取得了阶段性成效,全国上下正处于全面恢复社会经济秩序的新阶段。
反观大洋彼岸的美国, 当前却是“ 一地鸡毛” 。截至5月20日,美国新冠病毒累计确诊病例超154万例,占全球确诊病例的近三分之一;累计死亡病例增至逾9.3万例,占全球死亡人数的四分之一以上。
面对如此严峻的抗疫局势,作为保护美国公众免于生物、化学、放射性/ 核威胁和新发流行性传染病威胁的医疗产品监管部门,FDA是如何使用法律机制加快医疗应对产品的紧急使用?又是如何审评疫情相关药品、生物制剂、疫苗和器械的安全性和有效性?再又如何与政府其他部门协同防范公共卫生威胁并作出反应?
日前,JDB电子医药子公司美国汉佛莱法规部副总裁陈谨博士作客“ JDB电子研语” 直播间,以《美国面对紧急疫情的政策准备》为题,向广大网友介绍了美国FDA面对重大公共卫生紧急事件的相关举措以及应急使用相关医药产品的评审政策。

重大公卫事件中,FDA到底在做什么?
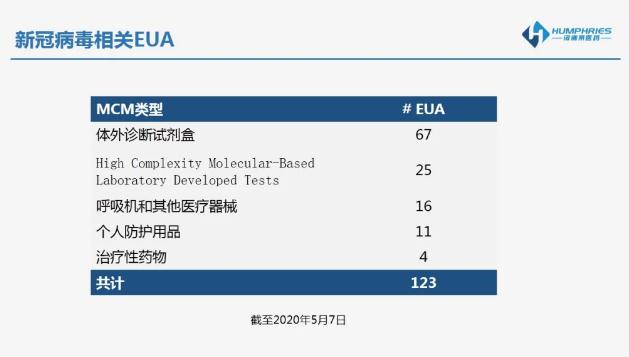
EUA到底有多强?
(1)出现由特定的化学、生物、辐射或核放射物等因素引发的严重公卫挑战或严重人类疾患;
(2)必须有理由相信,EUA覆盖的产品必须对上述人类疾患具有预防,诊断或治疗的功效;
(3)应该能够对EUA所覆盖产品的安全性和有效性在短时间内作出正确合理的初步评估;
(4)目前市场上没有可以应对上述人类疾患的充足产品或替代产品。
公卫事件终止后,
那些在研用药何去何从?
FDA应对严重公卫事件政策究竟有何措施



