

























上周,“袁来如此”专栏就PK LBA三个级别的方法验证策略展开了详细介绍(袁来如此|大分子生物分析概论(三_上):LBA定量方法验证的策略),围绕每个级别的验证中应评估的参数、相应的接受标准进行分享,本期将延续上期内容,继续分享后续相关内容。
文档记录是所有方法效能评估工作流程可重构性的一个重要组成部分。
对于监管级验证的方法,完整和及时的文档记录是建立方法有效性的必要条件。作为文档记录的核心内容,标准操作规程(SOPs)将规定监管级验证,包括需要评估的方法参数、每个参数的接受标准以及特定于某个方法的验证方案。编写某个具体方法的SOP时,应便于该监管级验证后的方法在研究中样本分析的应用,并且还需在每个研究阶段结束时提交正式的分析结果报告。
对于科学级验证的方法,其相关文档记录与监管级验证相比可以缩减,但必须确保在研究前验证和研究中样本分析阶段生成的数据的完整性和有效性。在每个阶段完成之后,操作者在报告或总结性文件中应当记录每项评估的结果。
对于研究级验证的工作流程,其相关文档记录与监管级和科学级验证相比可以进一步缩减,原因是使用研究级验证的方法其生命周期较短,进行简洁的文档记录即可。
监管级:对于每个监管级验证,其相关SOP应当详细介绍必须评估的方法参数、如何执行每个参数的评估、每个参数的接受标准以及适当的验证文档。此外,还应为每个方法准备一份正式的验证方案,提供与方法实施相关的具体信息,包括分析程序的描述说明、关键试剂和非关键试剂的列表、支持该研究的科学家的列表、验证标准操作程序的计划偏差以及计划偏差的理由。所有文档都必须存放在安全的环境中。
科学级:应撰写一份实施研究前验证的计划,预先记录待评估的参数及其接受标准,且需要对每个不同的方法所定义的关键参数进行评估,以确保恰当地实施研究前方法验证。有时可能需要更宽泛的接受标准,可根据以下几方面考虑:(1)项目的具体需要;(2)对方法开发过程中积累的数据进行科学评估;(3)如何利用研究中样本分析数据。若相关参数和接受标准是在验证之前作出,且在计划中提供了理论依据和评估时,则也是可以接受的。或者可以撰写一个专门描述需要评估的标准和科学级验证接受标准的SOP作为上述验证计划的替代或补充。如果验证实验与SOP中定义的标准不完全一致时,那么在执行支持科学级验证的实验之前,操作员应在验证计划中记录该偏差和出现计划偏差(planned deviation)的原因。
研究级:不需要正式的SOP或方案来执行研究前验证,但是建议预先确定好要评估的方法参数和接受标准,并记录下来(在执行的每个实验的目的范围内)。
监管级:对于监管级验证,在完成研究前验证和验证数据分析后,需提交正式报告,此验证报告应包括执行该分析方法的逐步说明,所有相关验证数据存储位置的列表以及验证实验中方法效能的评估。
在研究中样本分析开始之前,须有一份详细的SOP,概述如何使用该方法来确定未知测试样品的浓度。此外,还须在SOP中约定阐明允许对研究样本进行重复分析的标准、如何确定最终报告的结果以及有关重复分析的文档记录。
在研究中样本分析阶段结束时,分析人员须撰写正式的生物分析报告详细说明该方法的逐步执行过程、提供用于分析的生物药原液(drug stock)的信息、概述STD和QCs的效能、记录失败的分析运行和样本的列表、记录重新分析的样本以及记录对于验证过的方法或方法SOP的偏离。
研究前监管级方法验证的数据和研究中真实样本生物分析的数据的存档应不晚于研究报告和生物分析报告定稿的时间。
科学级:对于科学级验证,建议在完成研究前验证和验证数据分析后提交报告或总结文档。该科学级验证报告或总结文档应包括方法的逐步执行步骤、所有相关数据的存储位置、验证实验中方法的效能、研究中样本分析已确认的接受标准以及研究中样本分析计划(如适用,包括样本稀释方案、特定的分析程序、测试样本验收标准和允许样本重复分析的原因)。如果上述所有内容都简明扼要地在总结文档中列出,则无需再进行正式生物分析的方法SOP。
在研究中未知样本分析的总结文件中,应参考科学级验证的总结文档。分析人员可提交一份研究报告,以记录研究中样本分析的执行情况。此外,分析人员应发布一份生物分析报告,用于记录该方法的效能、所有失败的微孔板、微孔板/样本失败的原因以及样本分析过程中发生的偏差。
研究前科学级方法验证的数据和研究中样本分析的数据存档,应不晚于研究报告和生物分析报告的定稿时间。
研究级:对于研究级验证方法,则不需要在研究前验证执行后提交正式报告,但应提供研究前方法效能评估的简明文档,包括方法的执行步骤、相关的数据位置以及研究中样本分析确定的接受标准。
总而言之,不建议为样本分析制定正式的SOP,也不需要撰写正式的研究报告,但分析结果应在实验室记录本或其他适用的数据存储库中清楚地汇总说明。
对于PK定量分析方法的验证,即研究前和研究中方法的效能评估,采用上述三级式方法(第1级-监管级验证;第2级-科学级验证;第3级-研究级验证)不仅有利于生物分析业界,而且能通过实现更高效、更具成本效益的生物药开发来使患者受益。
分析人员选择适当的方法表征/验证级别,有助于战略性地合理使用有限的资源,确保支持新药发现或早期开发阶段的研究得到有效执行,具有一定的科学严谨性。
同时,还能高效产生关键决策所需的PK表征数据。当前制药行业对不断提高效率的要求正支持使用这种分级方式进行分析方法的效能评估。支持候选药物的选择或其它单次使用的方法的监管级验证表明,冗长的方法开发和验证与方法的使用频率或数据的预期应用并不匹配。
用于关键内部决策的数据存在内部时间敏感性,这也支持PK LBA方法验证的分级式方法。因为开发和监管验证(根据监管指南)这样的LBA方法,对项目进展来说实际上是昂贵的时间和金钱成本,甚至还延迟了患者获得新药的时间。
生物基质、测试试剂和药物的可及性也限制了早期药物的开发。越来越多的研究涉及稀有生物基质的使用,而其可及性则限制了LBA方法的开发和验证。此外,在药物开发计划的每个阶段,是否能得到合适的试剂会限制方法效能评估的范围,因为在药物发现阶段(新分子实体出现之前)通常没有特异性试剂抗体(例如anti-idiotypic antibodies)。然而,即使存在这些限制,仍然需要通过可靠、科学合理的分析方法来产生准确的PK结果,以便做出明智的决策。
在水晶城第五次会议上,FDA的代表澄清说,针对非关键决策或内部决策进行的研究将不受指南的约束,行业可以采取更加积极的方法平衡科学需求和监管要求,同时确保得到的数据有助于有效的决策。这种观点已经被小分子生物分析专家们所接受,他们已经开始讨论并建议在PK评估中使用BMV分级验证方法。小分子BMV和生物标志物评估倡导基于数据的用途来定制生物分析方法的开发和验证,这获得了一些监管部门专家的支持。然而,大分子生物分析在分析平台、基本方法论和大分子药物的生化/生物物理特性等方面与小分子生物分析存在本质上的不同,需要进行独立考察。
对于大分子生物药,LBA测试格式(以免疫测定的形式)是评估其PK特性的首选分析技术。定量分析生物基质中的大分子浓度存在许多复杂性,必须考虑它们与内源基质成分的相互作用和测试格式对定量的影响。生物药抗体的存在以及药物与靶点的相互作用,可能会给大分子药物的检测和精确定量带来问题。由于LBA方法有限的准确度和精密度以及使用非线性曲线拟合的必要性,使得大分子LBA方法无法采用与小分子LC-MS方法验证相同的接受标准。
此外,在整个药物开发过程中,对大分子药物的表达系统或缓冲液配方所做的更改可能会改变药物的结合作用和PK特性,因而不可能使用在前一个水平上经过迭代而构建的小分子分级式验证方式。由于这些差异,大分子生物分析方法性能的评估对于应用迭代的过程是有挑战的。
在生物药开发的整个生命周期中,可以使用不同级别的方法验证。应当指出,每一个级别都应被视为完全独立的方法评估。即使方法的试剂和测定步骤在研究级验证和监管级验证之间没有变化,也应分别在每个级别进行相应的方法验证。评价方法的效能是否可接受的严谨性也随着验证级别的增加而增加。如果有必要,应当重新开发和验证一个方法,以确保它符合必要的接受标准。但这并不是说,在不太严谨的级别使用该方法获得的经验不能应用于更严谨级别的方法开发上,而是不应简单地将附加参数添加到较低级别的评估中,因为偏差和%CV的接受标准可能更严格,对相关文档记录和期望的流程可重构性的要求也会增加。
对大分子方法效能的评估,即验证级别的选择,应当强调是一个通过基于可接受风险水平的决策。这些风险水平针对每种情况,例如在药物分子、分析方法、生物基质和物种水平上的风险进行特别的评估。最近,FDA在其指南草案中暗示分析人员使用更灵活的验证工作流程,指出:“对于需要监管机构的行动才能获得批准的,或者与药物标签(labeling)相关的关键研究,如生物等效性(BE)或PK研究,应完整地验证生物分析方法。对用于制药厂商内部决策的探索性方法,较少的验证可能就足够了”。在指南草案中,FDA还进一步澄清说,“本指南也适用于非临床药理学/毒理学研究的生物分析方法”。适当的分析方法表征和验证级别对于数据的预期用途应该科学合理,如果对选定适当的级别有任何疑问,则默认应该进行更严格的评估,或者最终进行监管级验证。
对于向监管部门提交的申报文件中的数据,如果数据可能对患者安全产生很大影响,或者这些数据是用于证明疗效(例如GLP非临床药理学/毒理学研究、支持剂量选择或标签声明的研究、在疾病适应症人群进行的临床I期研究),则需要对相关分析方法进行监管级验证(第1级,Tier 1)。对于非关键性研究(例如非GLP、在健康志愿者中进行的临床I期研究,如单次上升剂量(SAD)或多次上升剂量(MAD)研究时,当PK不是研究的主要或次要终点时、概念验证研究时),可以应用科学级验证(第2级,Tier 2)。
此外,当PK将作为GLP非临床或临床研究的一部分,在稀有的生物基质(例如,精液、关节腔滑液、诱导痰、口腔内拭纸、组织均质、支气管肺泡灌洗[BAL]液、尿液等)中进行评估时,可以使用科学级验证的分析方法(第2级,Tier 2),如FDA指南草案中说明的,本指南可能适用于血液和尿液的BA、BE和PK研究。对于用于内部决策(例如探索性研究、候选药物的选择、配方比较或对药理机制的研究)或作为非GLP 或药物发现研究中使用了稀有基质的PK评估,可以应用研究级验证工作流(第3级,Tier 3)。图1概述了在药物开发的各个阶段,可以应用于各个阶段的相应级别的方法验证流程。
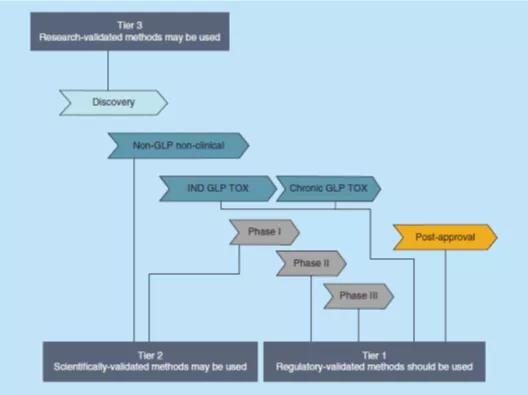
应该在方法开发阶段开始之前决定对该方法进行哪一级的验证,并基于上述优先标准作出决定,有助于开发符合其用途的方法,并防止“过度开发”仅需要研究级验证的方法,或防止重新开发一个需要监管级验证的方法来使其更加稳健或有更少的干扰,因为这两种情况都将可能耗费更多的资源和时间。如果对如何使用给定方法生成的数据有疑问,或者对某个药物开发项目进行不太严格的分析方法验证存在固有风险,则最好默认为选择更严格的验证级别。图2提供了一个示例决策树,以帮助选择适当的验证级别。
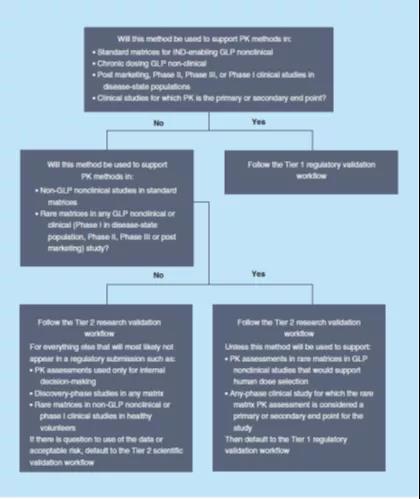
本文提出的分级方法验证模式,通过对分析方法进行不同级别的验证,目的是在已确立的监管指南范围之外,提供适合其目标生物分析数据的质量保证。本文为实施这种分级方式提供了一个切实可行的理论框架,并提出了预先选择适当验证级别的理由。这种方式基于合理的科学原理,并且在每一个项目上对不同级别的验证所伴随的风险进行独立的评估。建议各新药开发商针对各自独特的药物开发项目和情况,对分析方法效能的验证级别作出合理选择。
笔者认为可以初步划分监管级、科学级和研究级验证的适用范围如下(供讨论,与上文中一些建议和图表并不完全一致)。另外不同的药物开发商可以采用类似但并非完全一致的策略,特别是在科学级验证和研究级验证上:
1. 监管级验证:所有研究结果和数据必须纳入向监管机构提供的申报/注册文件,包括非临床GLP安全性研究、临床I期PK/PD研究、人体生物等效性研究、临床II/III期的关键PK或PD研究、药物标签(labeling)相关的研究等。
2. 科学级验证:研究结果和数据一般不会纳入向监管机构提供的文件中,除非监管机构有特别要求,有临床前non-GLP试点PK/PD研究(non-GLP pilot PK/PD/Tox studies in Tox animal species)、动物生物利用度研究、其它非关键性研究如制剂优化和候选药物的选择等。
3. 研究级验证:研究结果和数据仅供药物开发商内部使用,如首次动物PK/PD研究、候选药物的选择等。
4. 特别声明
本文如有疏漏和误读相关指南和数据的地方,请读者评论和指正。所有引用的原始信息和资料均来自已经发表的学术期刊、官方网络报道等公开渠道, 不涉及任何保密信息。参考文献的选择考虑到多样化但也不可能完备,欢迎读者提供有价值的文献及其评估。

